Química Orgánica
Ciencia que estudia las transformaciones que sufren los compuestos que poseen átomos de carbono.
El carbono tiene el 95% de las sustancias químicas
Química Actuales, la mitad es orgánico
Sustancias Orgánicas son responsables de la vida: Acido Nucleico, Proteinas, enzimas hormonas etc
Características de lo Orgánico e Inorgánico
Orgánico
-13 millones de compuestos: sintéticos y naturales
-Se encuentra en la naturaleza, animal, vegetal.
-Elementos Carbono , Hidrógeno
-Enlace Covalente
-Fusión 300º
-No soluble en Agua
-Solvente Orgánico
Inorgánico
-100.000 de compuestos
-Se encuentra libre en la naturaleza : sales y óxidos
-Usa todos los elementos de la tabla periódica
-Enlace Ionico, Alguna vez Covalente
-Funsión 700º
-Soluble en Agua
-No solvente Orgánico
Química del Carbono
Estudia todas aquellas sustancias en cuyas moléculas toma
parte el carbono
Carbono= Responsable de la gran complejidad
El Átomo de Carbono
*El carbono es el átomo más pequeño de su grupo forma los enlaces covalentes.
*Los cuadro electrones en su ultimo nivel de valencia es el responsable de la tetravalencia del carbono.
Existen tres cadenas geométricas diferentes
1. Cadena abierta lineal
2.Cadena cerrada, ciclo
3.Cadena abierta ramificada
Alotropos Principales
-Naturales = DIAMANTE Y GRAFITO
-Sintético=FULLERENO
DIAMANTE:Forma una Geometría tetraedrica y se forma una red Tridimencional.
GRAFITO:La capa se desliza una sobre otra fasilmente, se unen a otros tres y forman capas planas.
FULLERENO: Es una forma alotropa sintética del carbono.

Hibridaciones de Orbitales
Existen tres Orbitales Híbridos que son
Orbitales Híbridos SP3 (Enlace Simple)
Es una molécula tetraedrica, es decir forma un tetraedro, por sus ángulos entre si de 109.5º dando sus 4 orbitales.
Orbitales Híbridos SP2 (Enlace Doble)
Es una molécula Triangular Plana, formando un triangulo con angulo de 120º,dando sus 3 órbitas.
Orbitales Híbridos SP (Enlace Triple)
Es una molécula lineal, alineado de 180º con sus dos órbitas.
Enlaces Covalentes
Existen dos enlaces que superponen orbitales atómicos.
-Enlace Pi : Formando por la hibridacion que superpone lateralmente dos orbitales P.
-Enlace Sigma: El mas fuerte, que superpones dos Orbitales S

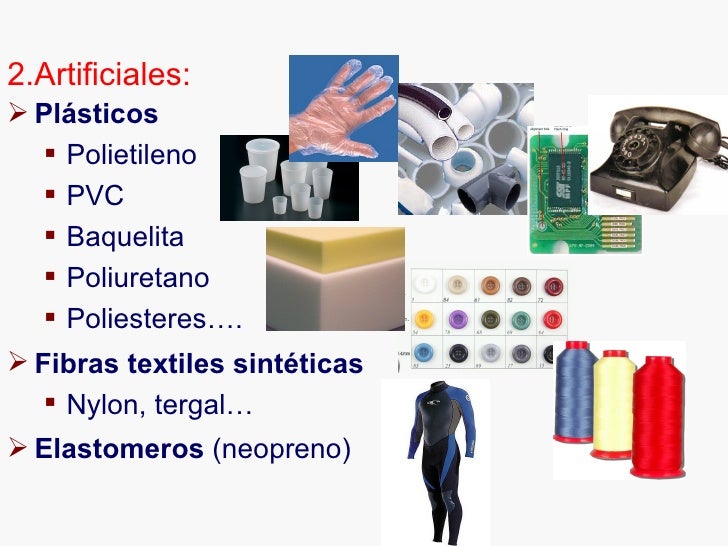

Buena información, cuidar solo un poco más la estructura y orden
ResponderEliminar